Ny studie kaster lys over lokal degenerering i HS
Hvorfor dør spesielle hjerneceller i HS? Ny forskning tyder på at årsaken er effektiviteten til cellulær gjenvinning
Av Dr Kurt Jensen 14. januar 2014 Redigert av Dr Jeff Carroll Oversatt av Knut Ellefsen Opprinnelig publisert 12. november 2013
Spesielle regioner i hjernen degenerer raskere enn andre i Huntingtons sykdom. Steven Finckbeiner’s team konkluderer med at denne forskjellen skyldes hjernecellenes evne til raskt å identifisere og kvitte seg med mutert HS protein. Spesielt er nevroner fra sårbare områder i hjernen sene med å kvitte seg med dette proteinet.
Vit når de skal foldes
Proteiner er store biologiske molekyler som utfører viktig arbeid for cellen. Straks et protein er dannet ved å sette sammen aminosyrer i en spesiell rekkefølge, folder proteinet seg sammen som en kringle i en unik 3-dimensjonal form. Det er kun når proteinet er korrekt foldet at det kan utføre sitt normale arbeid, hva nå enn det er.
Dessverre blir noen proteiner endret på vegen slik at de ikke lenger folder seg korrekt. Ved HS dirigerer en genetisk mutasjon en av aminosyrene til å repeteres om og om igjen i huntingtin proteinkjeden (Htt), som hakk i grammofonplaten (eller stamming om grammofonplaten er før din tid).
Denne forlengelsen forårsaker at Htt ikke foldes korrekt, blir toksisk for cellen og limer seg sammen i store klumper som forskerne kaller aggregater. Et passende bilde vil være hårdotter som tetter et utløpsrør: et enkelt hår går greit, men store dotter tetter røret.
Hos pasienter med HS ser det ut til at alle kroppens celler omgir seg med mutant HS protein, men det er fortrinnsvis hjerneceller som dør under sykdommen. Dette er hvorfor HS kalles en “nevrodegenerativ” lidelse. Faktisk, ikke bare dør hjernecellene, men i hjernen er det spesielle populasjoner av nevroner som dør tidligere og således ser ut til å være mest sårbare.
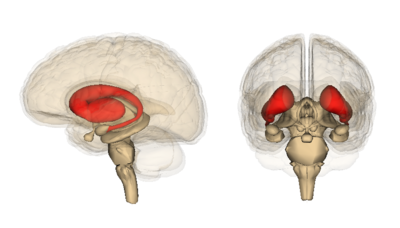
I særdeleshet er regionen i hjernen som viser tidligst og mest alvorlig celledød kalt striatum. Striatum er lokalisert dypt inne i senter av hjernen. Dens jobb er å koordinere frivillige bevegelser, tanker, sosiale interaksjoner og sikre at ting ikke kommer ut av kontroll.
Alt fra å stoppe en samtale til å stoppe en bevegelse er tatt hånd om av striatum. Det som er ekstremt viktig, men enda ikke forstått, er hvorfor dette området er så mottakelig for degenerasjon ved HS, mens andre områder ser ut til å takle mutant Htt mye lengre innen de dør.
«Nevroner overmettet med ekstra Nrf2 utskilte mutant Htt raskere enn normalt og levde lengre. Dette tyder på at å trimme cellenes eget gjenvinningssystem kan være et potensielt behandlingsmål i HS. »
Bær ut papirene og søpla og det mutante huntingtin
To mulige forklaringer for disse forskjellene ble undersøkt av et forskerteam ledet av dr. Steven Finkbeiner ved University of California i San Fransisco. En mulighet er at det kan være variasjoner mellom typer av hjerneceller hvor fort Htt danner toksiske strukturer. For hver celletype er det egentlig spørsmål om hvor fort hår blir hårdotter?
En annen mulig forklaring for selektivt tap av celler er at forskjellige regioner av hjernen kan skille ut og kvitte seg effektivt med mutant Htt forskjellig. Er noen celler ryddige nerder?
Forfatterne tenkte ut en teknikk som lot dem måle disse folde og utskillingsegenskapene i individuelle levende hjernecellekulturer. De fylte cellene med et lysende protein kalt “Dendra2”. Dette proteinet er egnet fordi det initialt lyser med en grønn farge (som et barns glødepinneleketøy), men det skifter til et rødfarget lys når det belyses med et spesielt farget lys.
Så da gjør dette verktøyet det mulig for deg å dyrke noen nevroner fylt med grønn Dendra2 for deretter å utsette dem for et lys som gjør Dendra2 rødt. Ved å observere hvor lang tid det tar cellen å etterfylle grønn Dendra2 og kvitte seg med rød Dendra2 forteller dette hvor fort cellen danner nye proteiner (grønne) og nedbryte gamle (røde).
Selvsagt bryr vi oss egentlig ikke om Dendra2. Det vi egentlig ønsker å vite er hvordan hjerneceller behandler normalt HS protein og om dette er endret av mutasjonen som forårsaker HS. For å kunne svare på dette spørsmålet brukte forskerne labtriks for å smelte sammen et normalt eller mutert HS protein med Dendra2 proteinet. Nå kunne de benytte det samme lystrikset for å følge HS proteinet.
Søppelmannen kan
Ved å bruke dette systemet fant man at mutant HS protein ble utskilt fra nevroner i striatum mye raskere enn normalt Htt. Dette er overraskende - mange forskere ville forutsagt at den mutante formen av proteinet ville vare lengre og at dvelingen ville forårsake at det dannet aggregater. Det antyder at nevroner er i stand til å gjenkjenne mutant protein og utpeke det som mål for utskillelse.
Det automatiske mikroskopet som Finkbeiner’s team har utviklet gjorde dem faktisk i stand til å se at desto raskere en individuell celle kvittet seg med mutant Htt, jo lengre levde cellen. Det gir mening - å rydde opp i toksisk søppel beskytter hjerneceller.
Så hvis cellens mutant protein gjenkjenning og oppbevaringssystem virker, hva er da problemet? Det viser seg at noen nevroner er bedre til denne utskillelsen enn andre, nemlig de i cortex. Cortex er den rynkete utsiden av hjernen. Generelt bukker celler i cortex under for HS senere enn celler i striatum. Med håp om å forstå hvorfor sammenlignet forfatterne utskillelsen av mutant HS protein i striatum med utskillelsen i cortex.
«Hovedfunnet i denne studien er at nevroner fra forskjellige områder i hjernen har forskjellig følsomhet for mutant Htt. Det kan gi en forklaring på hvorfor HS starter på et sted i hjernen og ikke et annet. »
Ganske riktig er nevroner i cortex bedre i stand til å kvitte seg med mutant Htt raskere. Nevroner i cortex levde også lengre enn nevroner i striatum. Forfatterne konkluderte med at dette er fordi disse regionene har gjenvinningsmetoder som er forskjellige i evnen til å skille ut mutant HS protein.
Når proteiner blir gamle eller utbrukte har cellene et system for å skille dem ut eller gjenvinne dem. Forskerne undersøkte om sine observasjoner kunne forklares ved effekter på dette nedbrytingssystemet. Spesielt fokuserte de på Nrf2, et protein som aktiverer gjenvinningssystemet.
Forskere kan studere hvor forskjellig cellulære prosesser bidrar til ting som celledød og gjenvinning ved å øke volumet av en spesiell prosess eller senke den. I dette tilfellet, fordi de trodde gjenvinningsprogrammene aktivert av Nrf2 er viktige, kan de gi cellene mer eller mindre av Nrf2. Dette hjelper dem å fastsette om en spesifikk prosess er viktig.
Dette er akkurat hva de gjorde for å studere Nrf2 og gjenvinning av det mutante HS proteinet. Nevroner overmettet med ekstra Nrf2 skilte ut mutant HS protein raskere enn normalt og var mindre tilbøyelige til å dø. Dette tyder på at å trimme cellenes eget gjenvinningssystem kan være et terapeutisk potensielt mål i HS.
I samsvar med denne ideen, når forskerne på kunstig vis reduserte cellenes primære avfalls eller gjenvinningssystem med medikamenter, ble cellene mindre i stand til å skille ut mutant HS protein. Så dette spesielle gjenvinningssystemet ser ut til å være avgjørende for å gjøre nevroner i stand til å håndtere toksiske proteiner.

Hva betyr dette for HS?
Hovedfunnet i denne studien er at nevroner fra forskjellige områder i hjernen har forskjellig følsomhet for mutant Htt. Det kan gi en forklaring på hvorfor HS starter på et sted i hjernen og ikke et annet. Den lille forskjellen er at denne følsomheten ser ut til å være basert på nevronenes forskjellige evner til å håndtere og kvitte seg med mutant protein på egen hånd.
Dette er faktisk veldig viktig fordi nevronenes kapasitet til å håndtere mutant Htt gir en interessant retning mot potensielle behandlingsformer.Basert på resultatene i denne studien kan vi gjette oss til at behandlinger som øker nevronenes evne til å utskille mutant Htt vil gjøre at nevronene lever lengre.
Imidlertid må denne interessante muligheten vurders i sammenheng. For det første ble hele denne studien utført på nevroner som ble dyrket i petriskåler. Det gjenstår å se om dette fenomenet også vil observeres i menneskelig sykdom, hvilket betyr mest.
For det andre er disse funnene sekundære siden de mulige behandlingsformene enda ikke finnes. Det vil ta tid å utvikle noe hensiktsmessig og teste det i andre HS modeller før det kunne blitt forsøkt på mennesker. For eksempel vet ingen hvilke skadelige bivirkninger som kunne oppstå hvis Nrf2 systemet ble kunstig økt over lang tid.
Poenget er at disse observasjonene er veldig spennende grunnleggende HS forskning. Og siden det enda ikke er noen godkjente medikamenter som angriper det grunnleggende problemet i HS, vil studier som denne gi bedre forståelse av denne fryktelige tilstanden og hjelpe på utviklingen an nye medikamenter.