Kan en 'rusten hengsel' forårsake Huntington sykdom?
Canadiske forskere har funnet ut at det muterte huntingtin-proteinet er mindre fleksibelt enn det normale.
 Av Professor Ed Wild 11. september 2013 Redigert av Dr Jeff Carroll Oversatt av Beate Rindal Opprinnelig publisert 27. august 2013
Av Professor Ed Wild 11. september 2013 Redigert av Dr Jeff Carroll Oversatt av Beate Rindal Opprinnelig publisert 27. august 2013
Å finne ut hvordan det muterte huntingtin-proteinet forårsaker skade er et sentralt problem innen huntingtonforskning. Nå har et team av canadiske forskere, ledet av Dr. Ray Truant, vist at proteinet har en viktig ‘hengsel’ funksjon som virker dårligere i celler med HS-mutasjonen. Spennende, men i motsetning til det du kanskje har lest tidligere, betyr ikke det at vi ikke lenger trenger å studere mus!
Huntingtin
En stor fordel for forskere som studerer Huntingtons sykdom, i motsetning til mange andre hjernesykdommer, er at vi vet nøyaktig hva årsaken er. En mutasjon i et enkelt gen får celler til å lage et skadelig protein: mutert huntingtin. Det er mutert huntingtin som skader nerveceller og andre celler og som forårsaker symptomene ved HS.
Siden dets oppdagelse for 20 år siden har vi funnet ut mye om hva det normale huntingtin-proteinet gjør, og hva som går galt når dens giftige tvilling, mutert huntingtin, lages.
Å studere huntingtin er avgjørende i vår innsats for å utvikle behandlinger for HS. Å finne ut hvordan og hvorfor mutert huntingtin forårsaker skade er et viktig skritt mot å forhindre skaden.
For mange glutaminer
Proteiner er laget av lange strenger av byggeklosser, kalt aminosyrer. Disse er satt sammen som et perlekjede og den nøyaktige rekkefølgen av aminosyrer bestemmer formen og virkemåten til proteinet.
En liten forandring i rekkefølgen av aminosyrer kan forårsake en stor forandring i et proteins form, kan dramatisk forandre måten det gjør jobben sin på eller til og med gjøre proteinet giftig.
Mutert huntingtin er forskjellig fra det “normale” proteinet på bare én måte: i begynnelsen av kjeden har huntingtin en sekvens hvor en byggekloss, glutamin, er gjentatt flere ganger. Det vanlige antallet glutaminer er mellom ti og tjue.
Huntingtons sykdom oppstår når det er for mange glutaminer.
Hva er det magiske tallet?
Så, hvor mange glutaminer må det til før huntingtin-proteinet begynner å forårsake skade? Merkelig nok, er svaret trettisju. Så vidt vi vet, forårsaker ikke huntingtin Huntingtons sykdom dersom antallet er lavere en dette. Over dette antallet er HS uunngåelig, så lenge en person lever lenge nok.
Hvorfor i all verden skulle ting endres ved 37 glutaminer? Vi vet ikke! Men å løse dette mysteriet er høyeste prioritet for HS-forskere.
Enda mer merkelig; mens flertallet av mennesker med Huntingtons sykdom har mellom 40 og 60 glutaminrepetisjoner, forårsaker ikke de ekstra glutaminene sykdom hos andre dyr, som mus. Dyremodeller av HS må ha godt over hundre glutaminer i deres huntingtin-protein før vi begynner å se symptomer.
Dette er et annet mysterium, og et som tyder på at huntingtin forårsaker subtile men svært viktige kjemiske problemer hos mennesker, som våre dyremodeller ikke kan detektere.
Hva med CAG?
«Humane celler kan bli brukt til å identifisere legemidler som hjelper hengselen til å fungere, men de må allikevel testes på dyr, inkludert mus »
Man kan spørre seg, hvor kommer disse ekstra glutaminene fra? Svaret ligger i HS-genet, som er en slags oppskrift eller et sett med instruksjoner for å lage huntingtin-proteinet. Akkurat slik som proteinet har mange glutaminer nær begynnelsen, har genet en strekke der de kjemiske ‘bokstavene’ C-A-G repeteres. Antallet ‘CAG’ i genet samsvarer med antallet glutamin-byggesteiner i proteinet. Og hvis det er for mange CAGs i genet vil det bli for mange glutaminer i huntingtinproteinet.
Så hva er nytt?
Professor Ray Truant, hans elev Nick Caron og Truants team ved McMaster universitetet i Canada, har nettopp publisert en artikkel i tidsskriftet PNAS som beskriver deres arbeid med å studere hvordan antallet glutaminer påvirker huntingtin-proteinet. For første gang har de funnet en potensielt viktig endring som skjer rundt det kritiske 37-glutamin antallet.
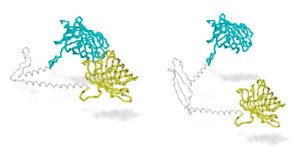
De strekkene av protein som finnes på hver side av glutaminene er biter som kalles ‘oppstrøms’ og ‘nedstrøms’ regioner. Tidligere forskning har antydet at hver av disse regionene spiller en rolle i å gi det muterte proteinet sine skadelige egenskaper.
Hva Truants team gjorde var å spørre seg om oppstrøms- og nedstrømsregionene faktisk kan jobbe sammen, mens glutaminbiten i midten fungerer som et hengsel. De har også lurt på om denne ‘hengselen’ kanskje ikke fungere skikkelig i det muterte proteinet.
På tide med en Ringenes Herre analogi
For å undersøke dette trengte de en måte å finne ut om oppstrøms- og nedstrømsregionene endte opp nær nok til å jobbe sammen. De brukte en slags smart ‘nærhetssensor’ kalt FLIM-FRET.
Kan du huske Frodos sverd ‘Sting’ i Ringenes Herre filmene, og hvordan det lyser blått når orkene er i nærheten? FLIM-FRET er på en måte likedan.
Forskerne festet spesielle lys-sensitive vedheng til huntingtin-proteinet, et på oppstrømsregionen og et på nedstrømsregionen. Disse gjør ingenting med mindre proteinet brettes over, og bringer de to regionene sammen. Når det skjer vil lys overføres fra et vedheng til et annet, stråle (som Frodos sverd) og lyset kan så bli målt.
HS og den rustne hengselen
Truants Sting-liknende nærhetssensor beviste at oppstrøms- og nedstrømsregionene ender opp brettet mot hverandre i celler, mens glutaminbiten opptrer som et hengsel. Videre, glødet det mindre klart når det var 37 eller flere glutaminer i huntingtin-proteinet, hvilket kan tyde på at problemene med hengslene begynner rundt dette antallet. Truant kaller dette ‘Rusty hinge hypotesen’ og antyder at dette er én måte det muterte proteinet kan gjøre skade.
Truants team bekreftet disse resultatene ved å bruke proteiner av flere forskjellige lengder og viste den samme abnormaliteten i hudceller tatt fra en pasient med Huntingtons sykdom.
Passer det inn?

Hvordan passer idéen om den ‘rustne hengsel’ med det vi allerede vet om det muterte huntingtin-proteinet?
Vel, vi vet at et annet protein som kalles PACSIN kan binde seg til huntingtins nedstrømsregion. Her, viste Truants team at det også kan binde seg til oppstrømsregionen, noe som tyder på at det kan være i stand til å holde de to regionene sammen, over glutaminhengselen - som en dør-lukke mekanisme.
Når PACSIN ble kunstig fjernet, glødet nærhetssensoren mindre, noe som tyder på at oppstrøms- og nedstrømsregionene hadde gått fra hverandre. Ved å endre adferden til PACSIN skulle man kunne overvinne hengselproblemet - en mulig ny tilnærming til behandling av Huntingtons sykdom.
Den andre linken til vår eksisterende forståelse kommer fra små kjemiske endringer som celler gjør med proteiner. Disse kjemiske ‘merkelappene’ kan endre hvordan proteiner oppfører seg og hvor de ender opp. Truants taem hadde tidligere vist at fosfat-merkelapper er viktige for å bestemme hvor huntingtin-proteinet går og hvor skadelig det er.
I sitt siste arbeid viste de at disse fosfat-merkelappene også kan ha en effekt på aktiviteten av glutaminhengslene. Dette gir ytterligere støtte for idéen om at legemidler som kan kontrollere fosfat-merking kan være i stand til å forhindre noen skadelige virkninger av det muterte proteinet.
Hva denne forskningen viser
Truants gruppe har gjort et godt arbeid; funnet opp en nærhetssensor (eller lånt en fra Frodo Baggins) og brukt den for å vise at huntingtins viktige glutaminregion - den biten som er for lang ved HS - fungerer som en hengsel, slik at oppstrøms- og nedstrømsregioner kan arbeide sammen.
Samtidig spenner et annen protein, PACSIN, seg over hengselen og trekker regionene sammen. De har også knyttet hengselfunksjonen til fosfat-merking av huntingtin. Videre synes denne hengselegenskapen å gå galt ved omtrent samme antall glutaminer som forårsaker sykdom hos mennesker.
Ikke bare er dette ny viten om huntingtin-proteinet og hvordan det fører til skade. Det gir oss også nye ideer om mulige behandlinger - ved å endre oppførselen til PACSIN1 eller mekanismen som kontrollerer fosfat-merking.
Hva den ikke viser
Dette ville ikke være en HDBuzz artikkel uten en liten varsomhetsmerknad. I dette tilfellet tror vi det er viktig å fremheve noen av det forskningen ikke fortelle oss - i motsetning til hva du kanskje har lest på nettet.
CBC News rapporterte at arbeidet “omgår behovet for musestudier” fordi det var mulig å se Truants funn i menneskeceller. Dessverre er ikke dette sant. Menneskeceller kan bli brukt til raskt å identifisere medikamenter som hjelper “hengslen” til å fungere bedre, men disse medikamentene vil fortsatt trenge å bli testet på dyr, inkludert mus. Får å slå HS, trenger vi all den hjelpen vi kan få. Ingen enkelt dyremodell er perfekt for å utvikle medikamenter - det er heller ikke humane celler som vokser i en skål, eller pasienter for den saks skyld. Ulike modellsystemer bidrar alle med nyttig informasjon som hjelper oss å gjøre fremskritt.
En annen sak dette arbeidet ikke gir oss er en fullstendig forståelse av hvordan hengselproblemet gjør huntingtin-proteinet skadelig. I forskning ser vi ofte at bak hver dør, finner vi en annen dør som krever mer arbeid å åpne. Truants gruppe og andre, vil nå jobbe med å forstå det store bildet på hvordan huntingtin-hengselproblemet påvirker cellene og hjernen. Å gjøre disse funnene om til en behandling som kan benyttes av pasienter vil fortsatt trenge mer arbeid. Så vi fortsetter!